Пропедевтика детских болезней | Страница: 27
- Georgia
- Verdana
- Tahoma
- Symbol
- Arial
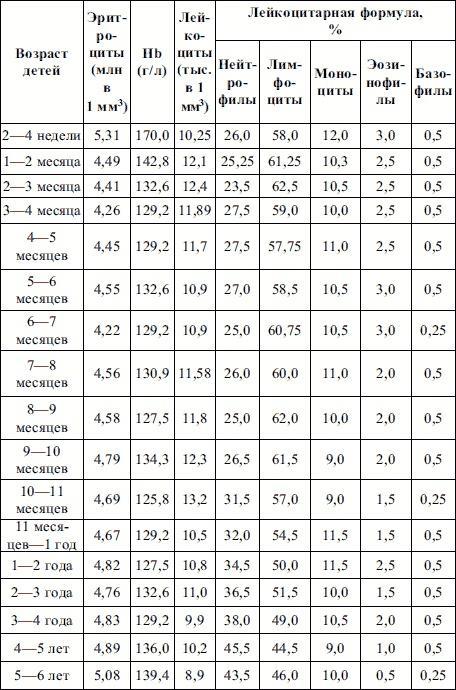
Таблица 3. Гемограмма здорового ребенка
2. Лимфоидная система и иммунитет у ребенка
Лимфоидная система представлена вилочковой железой, селезенкой, лимфатическими узлами, циркулирующими лимфоцитами, скоплениями лимфоидных клеток в миндалинах, пейеровых бляшках подвздошной кишки. Вилочковая железа закладывается на 6-й неделе внутриутробного развития. Ее быстрое увеличение начинается с 14-й недели, рост продолжается в поснатальном периоде с максимальным размером в 6—12 лет и последующей инволюцией. Селезенка закладывается на 5-й неделе, к рождению не заканчивает своего полного развития, ее вес от общей массы тела составляет 0,25—0,3 %.
Функции изучены недостаточно. Селезенка является основным местом разрушения стареющих эритроцитов и тромбоцитов. В ней происходит частичный синтез иммуноглобулинов и антител. Лимфатические узлы формируются со 2-го месяца внутриутробного развития: вначале шейно-подключичные, легочные, ретроперитонеальные, паховые. Окончательное формирование (фолликулов, синусов, стромы) продолжается в постнатальном периоде. После рождения в связи с антигенной стимуляцией укрупняются зародышевые центры лимфоидных фолликулов.
На первом году недостаточно развиты капсула и трабекулы, что создает трудности при пальпации. Максимальное их количество достигается к 10 годам. У взрослых масса лимфатических узлов составляет 1 % массы тела. Функция лимфатических узлов – барьерная; бактерии, инородные тела, принесенные с током лимфы, задерживаются в синусах лимфатических узлов и захватываются макрофагами. У детей первых 2 лет жизни барьерная функция лимфатических узлов низкая, что приводит к генерализации инфекции. Первые скопления лимфоидной ткани в желудочно-кишечном тракте появляются в 3–4 месяца внутриутробного развития, к рождению количество лимфатических фолликулов невелико. Лимфоидный аппарат желудочно-кишечного тракта (ЖКТ) играет существенную роль не только в синтезе сывороточных иммуноглобулинов, но и в местном иммунитете, предохраняющем организм от инвазии инфекционных агентов.
У взрослого ежедневно синтезируется до 3 г IgA ежедневно. Недостаточное развитие лимфоидного аппарата пищеварительного тракта к рождению объясняет легкую восприимчивость детей 1-го года жизни к кишечным инфекциям, что ведет к аллергической реакции вызванной энтеральным путем.
Лимфоциты, прежде чем попасть в кровяное русло, проходят через вилочковую железу. С возрастом у детей происходит постепенное снижение содержания лимфоцитов в периферической крови. Особенно интенсивно увеличение массы лимфоцитов происходит на первом году жизни, после 6 месяцев их число остается относительно стабильно до 8 лет, затем вновь начинает возрастать. У детей раннего возраста большее число лимфоцитов имеется в лимфоидной системе вследствие антигенной стимуляции, особенно значительной в первые дни, недели и месяцы жизни.
Неспецифические механизмы играют важную роль как у плода, так и у детей первых дней и месяцев жизни. Они включают анатомические барьеры для проникновения инфекции. Это кожа с ее секреторным аппаратом и бактерицидными компонентами секрета потовых и сальных желез, барьеры слизистых оболочек с мукоцилиарным клиренсом в бронхах, моторикой кишечника и мочевыводящих путей. Содержание лизоцима (фермента, разрушающего мукополисахарид бактериальных оболочек) в сыворотке крови к рождению высокое, превышает таковой у взрослых.
Содержание пропердина, принимающего участие в альтернативном пути активации комплемента в момент рождения, низкое, быстро нарастает и держится на высоком уровне на протяжении детства. Интерфероны продуцируются клетками, первично пораженными вирусами (наиболее активно – лейкоцитами), блокируют образование РНК, необходимого для репликации вируса, усиливают фагоцитоз. Низкие дозы интерферонов способствуют антителообразованию. Способность к образованию интерферона сразу после рождения высокая, но у детей первого года жизни она снижается, с возрастом постепенно увеличивается, достигая максимума к 12–18 годам. Низкий уровень интерферона объясняет повышенную восприимчивость детей раннего возраста к вирусной инфекции.
Система комплемента состоит из двух параллельных систем: классической и альтернативной (пропердина). Активированные компоненты системы комплемента усиливают реакции фагоцитоза и лизис бактериальных. Система комплемента закладывается на 8—15-й неделе гестационного периода, но к моменту рождения общий уровень комплемента в пуповинной крови равен только половине его уровня в крови матери. В 1-ю неделю жизни он быстро нарастает и с возраста 1 месяца не отличается от уровня у взрослых.
Фагоцитоз является ранним защитным механизмом плода. Циркулирующие фагоциты – лейкоциты полиморфно-ядерные, моноциты, эозинофилы, фиксированные в тканях фагоциты – макрофаги, клетки селезенки, звездчатые ретикулоэндотелиоциты – купферовские клетки печени, альвеолярные макрофаги легких, макрофаги лимфатических желез, клетки микроглии мозга. Клетки фагоцитарной системы появляются в ранние сроки развития плода – от 6 до 12-й недели гестации. Нейтрофилы являются микрофагами, крупные мононуклеарные клетки, тканевые или циркулирующие, относятся к моноцитам.
Все время фетального периода лейкоциты обладают низкой способностью к фагоцитозу. Поглотительная способность фагоцитов у новорожденных развита достаточно, но завершающая фаза фагоцитоза формируется в более поздние сроки – через 2–6 месяцев.
Активность фагоцитоза повышается за счет опсонизации, с дефицитом компонентов системы комплемента связывают недостаточную эффективность фагоцитарной защиты у новорожденных.
Обычно дефицит фагоцитарных реакций проявляется увеличением лимфических узлов, частыми кожными и легочными инфекциями, остеомиелитом, гепатоспленомегалией.
Вторичные нарушения фагоцитоза, как правило, развиваются на фоне медикаментозной терапии (при длительном применении цитостатиков). Специфический иммунитет осуществляется Т– и В-лимфоцитами. Становление всех систем как клеточного, так и неспецифического иммунного ответа начинается при сроках около 2–3 недель, когда формируются мультипотентные стволовые клетки. Общая стволовая клетка-предшественница всех субпопуляций лимфоцитов, нейтрофильных лейкоцитов и моноцитов может быть идентифицирована как СD34 + Т-клетки. К 9—15-й неделе жизни появляются признаки функционирования клеточного иммунитета. Реакции гиперчувствительности замедленного типа достигают наибольшего функционирования после рождения – к концу первого года жизни. Первичный лимфоидный орган – тимус – закладывается на сроке около 6 недель, и окончательное гистоморфологическое созревание претерпевает к возрасту гестации около 3 месяцев. С 6 недель у плода начинают типироваться HLA антигены, с 8–9 недели в вилочковой железе появляются малые лимфоциты, под влиянием гуморальных стимулов Т-лимфоциты дифференцируются в цитотоксические клетки, клетки-хелперы, супрессоры, клетки памяти. К моменту рождения абсолютное число Т-лимфоцитов у ребенка выше, чем у взрослого, но их характеристики ниже, чем у взрослых. Дифференцировка В-клеток начинается в печени или костном мозге. В ходе дифференцировки В-лимфоцитов осуществляется делеционная рекомбинация с генами иммуноглобулинов.