120 лет жизни – только начало. Как победить старение? | Страница: 37
- Georgia
- Verdana
- Tahoma
- Symbol
- Arial
С возрастом происходит глобальное деметилирование генома, вызывающее активацию генов, которые в норме должны «молчать». Оно провоцируется поломками хромосом, возрастным снижением активности ферментов, расставляющих метильную метку, избытком аминокислоты гомоцистеина, недостаточным уровнем половых гормонов. На вероятность деметилирования существенно влияют образ жизни человека и окружающая среда, включая особенности питания. Например, недостаток потребления и усвоения в старости витаминов — фолиевой кислоты и B12, микроэлементов цинка и селена.
Напротив, ряд важных генов, например гены рецепторов половых гормонов, теломеразы, репарации ДНК в некоторых тканях испытывают избирательное гиперметилирование. Этот вид эпимутации приводит к отключению функции данного гена. Причины возрастного гиперметилирования пока не ясны. Но уже сегодня понятно, что управление процессом метилирования может дать один из подходов к управлению старением.
Критерий 2. Нарушение регуляции
Регуляция обмена веществ, постоянства внутренней среды (гомеостаза), а также осуществления системных функций (дыхание, выделение, пищеварение, кровообращение, иммунитет) жизненно важна. Ее нарушение приводит к различным заболеваниям и повышает вероятность смерти. В то же время все эти регуляторные процессы подвержены возраст-зависимым изменениям, большинство из которых неблагоприятно. Например, нередко утрачивается способность поддерживать постоянство концентрации сахара, липидов и электролитов в крови, pH крови, артериального давления, уровней гормонов. По нашему убеждению, нарушение регуляции — ключ к старению. Данный процесс проявляется на ранних этапах старения, его обострение ускоряет старение, противодействие ему замедляет старение. Рассмотрим его подробнее.
Нейроэндокринная регуляция
Физиологическая регуляция всех функций организма находится под контролем нервной и эндокринной систем, каждая из которых претерпевает существенные изменения при старении.
Наши эксперименты показали, что для того, чтобы существенно продлить жизнь подопытных животных, можно активировать определенные гены не во всем теле, а лишь в центральной нервной системе. Многочисленные исследования других авторов (группы Доншенг Каи из Колледжа Альберта Эйнштейна, коллектива под руководством Томаса Бартфаи из Института Скриппса в США) также подтвердили, что активация или подавление определенных генов в центральном нейроэндокринном регуляторе метаболизма — гипоталамусе — замедляет старение во всем теле.
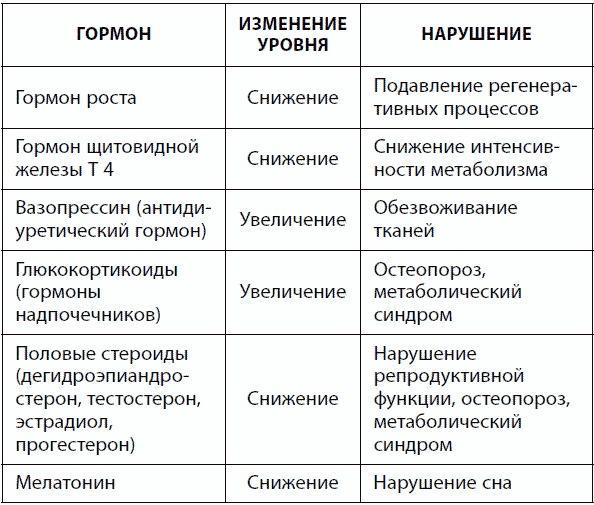
Сосудистые изменения в головном мозге в результате артериальной гипертензии и атеросклероза, снижение метаболизма нейронов, падение уровня передатчиков нервного сигнала, накопление токсичных агрегатов амилоидных белков, хронический психологический стресс способствуют развитию старческой деменции, депрессии, нейродегенеративных патологий (болезнь Альцгеймера, болезнь Паркинсона). С возрастом нарушается функция таких отделов центральной нервной системы, как гипоталамус, гипофиз и эпифиз, что негативно влияет на работу периферических эндокринных желез (щитовидной, поджелудочной, надпочечников, половых желез) и диффузной эндокринной системы. В результате выходят за пределы нормы и суточной ритмики многие жизненно важные гормоны, что повышает риск десятков заболеваний (табл. 17).
Таблица 17. Гормональные нарушения при старении
Регуляторные пути клетки
Спустимся с организменного уровня на уровень клетки. Здесь тоже старение обусловлено нарушением регуляции. Примерно половина всех белков, принимающих участие как в развитии возраст-зависимых патологий, так и в обеспечении долголетия человека, — это регуляторные белки, требующиеся для восприятия и передачи сигналов между клетками и извне. Гормональные сдвиги, нарушения межклеточных коммуникаций и генетическая нестабильность обусловливают изменение регуляции активности сотен и тысяч генов, в зависимости от типа ткани, и прежде всего генов, необходимых для роста и деления клеток, а также для обеспечения стрессоустойчивости.
Регуляция иммунитета
Старение связано с нарушением естественной регуляции иммунитета. Иммуностарение затрагивает как врожденный, так и приобретенный иммунитет. Врожденный иммунитет — эволюционно наиболее древняя его форма, активная с рождения, до встречи с конкретным патогеном. Ее обеспечивают клетки-фагоциты, которые проникают из крови в очаг воспаления и убивают инфекцию, нередко повреждая и собственные клетки организма.
Приобретенный иммунитет — эволюционно молодая форма защиты, выражающаяся в производстве специфических антител, нейтрализующих патоген. Ее реализация требует предварительного контакта с данным вирусом или бактерией. В то время как адаптивный иммунитет с возрастом угнетается, врожденный, напротив, активизируется.
С возрастом происходит постепенная утрата тимуса — органа, в котором происходит созревание иммунных Т-клеток. У пожилых людей, как правило, нарушена активация и способность к делениям таких клеток иммунной системы, как Т— и В-лимфоциты и естественные киллеры. В результате этих нарушений регуляции при старении наблюдается реактивация латентных вирусных инфекций под действием затаившихся в геноме вирусов, увеличивается заболеваемость различными инфекциями, аутоиммунными патологиями, повышаются риски опухолевых процессов.
Ожирение ускоряет старение тимуса и понижает иммунитет
Группа американских ученых из Университета штата Луизианы в опытах на мышах установила, что ожирение нарушает формирование Т-лимфоцитов и вызывает преждевременное старение тимуса. Полученные на мышах результаты, видимо, применимы и к людям, поскольку у страдающих ожирением людей среднего возраста, независимо от того, есть ли у них диабет 2-го типа, также нарушена функция тимуса. Таким образом, можно сделать вывод, что ожирение ускоряет связанную со старением инволюцию тимуса, что в итоге снижает разнообразие Т-лимфоцитов, ограничивая иммунную защиту.
Напротив, происходит гиперактивация воспалительных функций — увеличивается образование медиаторов воспаления. Клетки соединительной ткани (фибробласты), которые состарились и перестали делиться, а также избыточные жировые клетки становятся для организма источником воспалительных гормоноподобных белков — цитокинов, что приводит к системным воспалительным процессам, способствующим новому витку нейродегенерации, ишемической болезни сердца, заболеваниям почек, желудочно-кишечного тракта.
Критерий 3. Нарушение обмена веществ
Водно-солевой баланс
Результаты исследований, выполненных на экспериментальных животных и человеке, указывают на то, что процесс старения сопровождается изменениями в способности тела регулировать баланс воды и электролитов, прежде всего натрия. Как правило, происходит дегидратация тканей, гипо— или гипернатриемия, наблюдается в целом негативный минеральный баланс. Кроме того, пожилые люди гораздо более восприимчивы к изменению этого баланса, чем молодые. Основные причины этих изменений отражены в таблице 18.